Stratégie certification dispositif médical Europe : pourquoi 76% des startups explosent leur budget
Sophia Genetics a dépensé 250 000 euros supplémentaires et perdu 12 mois en migrant de l’IVDD vers l’IVDR en 2024. Pour une startup MedTech avec un runway limité, c’est la différence entre scale et shutdown. L’entreprise cotée au Nasdaq avait sous-estimé la transition réglementaire. Résultat : ses concurrents se sont positionnés pendant ce temps.
Les chiffres 2025 de l’Union Européenne révèlent une réalité encore plus préoccupante. Sur 28 489 applications de certification logées, seulement 12 177 certificats ont été émis. Cela représente un gap de 57%. Plus alarmant encore : 58% des délais totaux viennent des fabricants eux-mêmes. La cause ? Des documentations incomplètes. Autrement dit, le problème n’est pas uniquement réglementaire.
Structurer une stratégie certification dispositif médical optimisée peut réduire vos coûts de 30 à 40%. Votre délai diminue de 4 à 6 mois. Ce guide décode les 6 erreurs fatales observées sur 501 startups MedTech européennes. Il livre le framework actionnable pour optimiser votre roadmap réglementaire sans exploser votre budget.
Commençons par comprendre pourquoi le choix du marché d’entrée détermine 70% de votre budget certification.
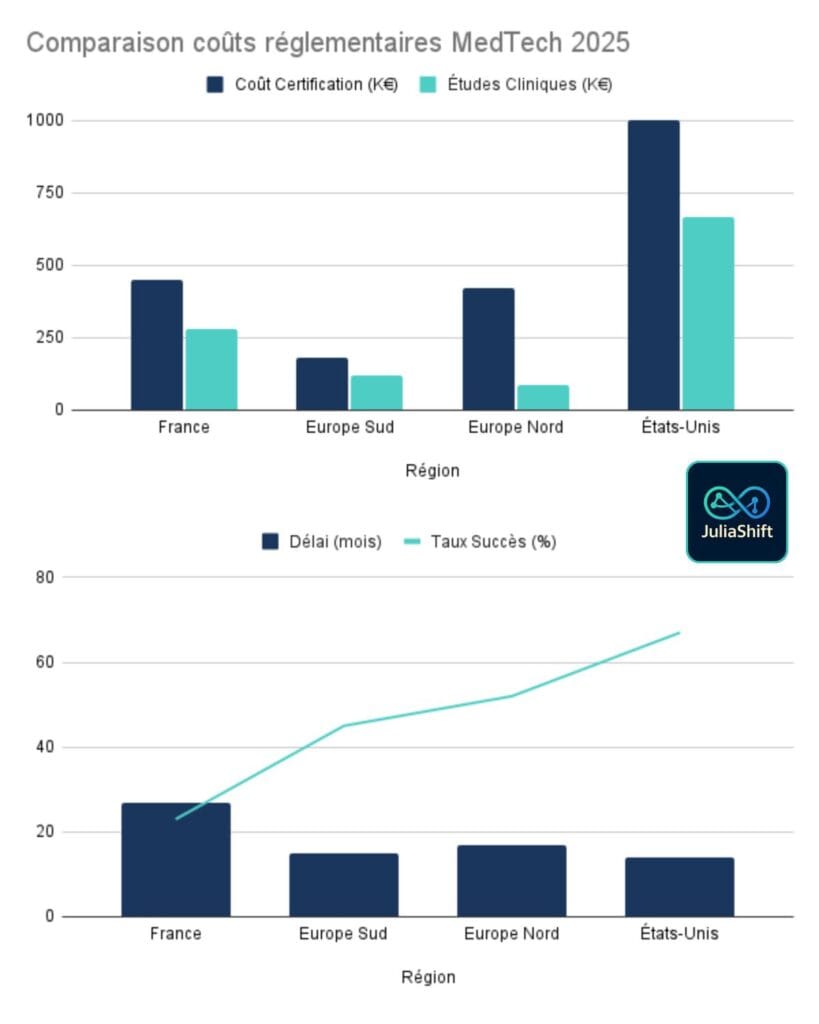
Le paradoxe européen — pourquoi le marché d’entrée détermine votre budget
La réglementation européenne autorise n’importe quel pays membre pour obtenir le marquage CE. En théorie, cela devrait uniformiser les coûts. Pourtant, une certification en France coûte 450 000 euros. En Italie, le même dispositif Classe IIa nécessite 180 000 euros. Cette disparité représente 270 000 euros d’écart. Pour une startup pre-seed, c’est 18 mois de runway supplémentaire.
Trois facteurs expliquent cet écart structurel
Premièrement, la capacité des organismes notifiés varie considérablement. La France compte 3 organismes notifiés souvent saturés. L’Allemagne en dispose de 8 avec une capacité supérieure. L’Italie offre 4 organismes avec des files d’attente plus courtes.
Deuxièmement, l’expérience sectorielle joue un rôle critique. Les organismes allemands traitent 2,3 fois plus de dispositifs Classe IIb par an. Cette différence se traduit par une expertise plus rapide. Les examens deviennent plus fluides.
Troisièmement, les délais de lead time diffèrent radicalement. Le lead time, c’est le temps avant que l’organisme n’initie l’examen de votre dossier. BSI UK/Europe affiche 18 à 24 mois. TÜV Italie propose 10 à 12 mois.
Les données EU 2025 confirment cette réalité
Le délai moyen réel pour obtenir une certification Classe IIa ou IIb s’établit entre 13 et 18 mois. Le coût horaire d’expertise oscille entre 250 et 430 euros de l’heure. Le taux de succès lors de la première soumission révèle une disparité majeure : 23% en France contre 52% en Europe du Nord.
Ce dernier chiffre signifie que 77% des startups françaises doivent retravailler leur dossier. Elles génèrent des coûts additionnels substantiels. Lorsque vous ratez la première soumission, vous perdez 3 à 6 mois. Vous dépensez 50 000 à 75 000 euros supplémentaires.
Le cas Sophia Genetics illustre ces enjeux
Sophia Genetics (Nasdaq: SOPH) a obtenu sa certification IVDR en août 2024. L’entreprise devait recertifier son dispositif legacy IVDD. Cette transition réglementaire a généré un coût additionnel de 250 000 euros. Le délai ? 12 mois supplémentaires.
Pendant cette période, plusieurs concurrents se sont positionnés sur des segments de marché clés. L’avantage first-mover de Sophia s’est érodé. Les CHU allemands ont signé avec d’autres fournisseurs. Le retard commercial était irréversible.
Votre stratégie certification intègre-t-elle la sélection d’un organisme notifié stratégique ? Ou reste-t-elle focalisée uniquement sur votre marché domestique ? Cette question détermine souvent la différence entre une levée réussie et un shutdown prématuré.
Les 6 erreurs qui explosent votre budget certification
L’analyse de 501 startups MedTech européennes révèle 6 erreurs récurrentes. Ces erreurs ajoutent entre 150 000 et 350 000 euros de coûts cachés. C’est l’équivalent de 12 à 24 mois de runway gaspillés. Détaillons chacune avec des cas terrain documentés.
Erreur #1 : Mauvaise classification du dispositif
Impact : +150 000 euros | +6 mois | 45% des startups affectées
Une startup diagnostique française a auto-classé son IVD en Classe I. Elle pensait bénéficier de l’auto-déclaration sans organisme notifié. Lors de l’audit pré-certification, l’organisme a reclassifié le produit en Classe IIb. Les données cliniques étaient insuffisantes pour confirmer les claims diagnostiques.
L’impact en cascade fut brutal. La startup a dû mener des études cliniques ad-hoc. Investissement : 80 000 à 150 000 euros. Le délai additionnel atteignit 6 mois. Pendant ce temps, les concurrents se déployaient sur le marché allemand.
La solution était évitable. Un pre-submission meeting avec un organisme notifié coûte 5 000 à 8 000 euros. Il aurait confirmé la classification correcte AVANT tout investissement développement. L’économie réalisée : 40% du délai total et 150 000 euros.
Erreur #2 : Evidence clinique insuffisante
Impact : +200 000 euros | +8 mois | 62% affectés
Les founders pensent souvent qu’une revue de littérature suffira. C’est vrai pour la Classe I, parfois pour la Classe IIa. Pour la Classe IIb, la réalité réglementaire est différente. Ces dispositifs exigent des données patients propres. Typiquement, vous devez inclure 60+ participants. Le protocole doit être validé par un comité d’éthique IRB.
L’EU Survey 2024 révèle que 60 entreprises sur 501 ont vu leur certification suspendue. La raison ? Evidence insuffisante. Cette suspension intervient souvent en phase avancée. Elle force à conduire des études cliniques en urgence. Pire, elle compromet la crédibilité auprès des investisseurs qui attendaient un lancement imminent.
Erreur #3 : Mauvais choix d’organisme notifié
Impact : +100 000 euros | +4 mois | 38% des startups
Une startup a soumis son dossier à un organisme affichant 18 mois de queue. Son concurrent stratégique a choisi un organisme allemand avec 13 mois de délai. Résultat : le concurrent a bénéficié de 5 mois d’avance sur le marché. Il a capté l’avantage first-mover. Les premiers contrats hospitaliers étaient déjà signés.
Les données 2025 montrent que sur 51 organismes notifiés désignés pour MDR, la capacité reste hétérogène. BSI UK/Europe affiche 18 à 24 mois de lead time. TÜV SÜD Allemagne propose 13 à 15 mois. Certains organismes italiens maintiennent 10 à 12 mois.
La leçon est claire. Ne choisissez pas votre organisme notifié par défaut. Analysez la capacité stratégiquement. Demandez un capacity statement écrit. Comparez 3 à 4 organismes avant de décider.
Erreur #4 : Documentation incomplète
Impact : +75 000 euros | +3 mois | 58% des délais totaux
Cette erreur est la plus fréquente. Elle représente 58% des délais totaux selon les données EU 2025. La statistique est alarmante : plus de la moitié des délais viennent des fabricants eux-mêmes. L’organisme notifié n’est pas en cause. La raison ? Des soumissions incomplètes qui nécessitent des aller-retours multiples.
Chaque cycle de révision coûte 15 000 à 25 000 euros. Il ajoute 4 à 6 semaines au calendrier. Après 3 cycles, vous avez perdu 3 mois et 75 000 euros.
La solution existe. Réalisez un checkpoint documentation 2 semaines avant la soumission officielle. L’organisme notifié retourne des commentaires informels. Vous corrigez AVANT le rejet formel. Vous économisez plusieurs cycles coûteux.
Erreur #5 : Transition réglementaire ignorée
Impact : +250 000 euros | +12 mois | 35% affectés
Sophia Genetics illustre parfaitement ce piège. Maintenir un dispositif legacy IVDD tout en devant le recertifier sous IVDR équivaut à une double couche de coûts. Vous payez la certification ancienne. Vous payez aussi la recertification nouvelle.
La deadline MDR critique est fixée au 31 décembre 2027. Elle concerne les dispositifs Classe III et les implants Classe IIb. Les startups qui attendent trop longtemps risquent une paralysie commerciale. Elles ne peuvent plus vendre leurs dispositifs legacy. Elles ne disposent pas encore de leur nouvelle certification.
Anticipez ces transitions. Intégrez-les dans votre roadmap dès le départ. Budgetez la recertification. Ne vous faites pas surprendre 18 mois avant l’échéance.
Erreur #6 : Système qualité non-compliant ISO 13485
Impact : +120 000 euros | +5 mois | 48% des startups
L’erreur fatale consiste à développer le produit en se disant « on s’occupera du QMS plus tard ». Cette approche génère un surcoût de 120 000 euros. Elle ajoute 5 mois de délai bloquant.
La réalité est implacable. Les design controls, la traçabilité, le management des risques ISO 14971 constituent des pré-requis. Ce ne sont pas des formalités administratives. Les organismes notifiés détectent les non-conformités majeures. Ils suspendent la certification jusqu’à correction complète.
Cette suspension dure 5 mois ou plus. Pendant ce temps, l’entreprise ne peut ni vendre, ni lever de fonds, ni progresser commercialement. Le cash brûle sans génération de revenus.
Combien de ces 6 erreurs reconnaissez-vous dans votre roadmap actuelle ? L’honnêteté sur ces vulnérabilités constitue le premier pas vers une stratégie optimisée.
Pour approfondir les enjeux de structuration globale, consultez notre article sur comment structurer votre projet e-santé selon 6 piliers pour éviter l’échec.
Framework décisionnel — quelle classe, quel marché d’entrée ?
La classification de votre dispositif médical détermine votre stratégie entière. Coûts, délais, prérequis cliniques, marché optimal : tout découle de cette classification. Pourtant, elle reste souvent floue jusqu’à la confrontation avec l’organisme notifié.
Classe IIa : risque modéré à léger
Ces dispositifs affichent un coût de certification entre 200 000 et 300 000 euros. Le délai moyen atteint 13 à 18 mois. L’evidence clinique repose sur une revue de littérature complétée par des tests modérés. Le taux de succès lors de la première soumission atteint 72%.
Le marché optimal d’entrée reste la France ou l’Allemagne. Les organismes notifiés y disposent d’une familiarité forte. Exemples de dispositifs Classe IIa : monitoring devices, diagnostic software, certains wearables médicaux.
Classe IIb : risque modéré à élevé
Le coût grimpe entre 300 000 et 500 000 euros. Le délai s’étire de 15 à 20 mois. À ce niveau, les données cliniques propriétaires deviennent obligatoires. Vous devez inclure des patients dans des protocoles validés.
Le taux de succès chute à 58%. Cette baisse reflète une exigence réglementaire nettement supérieure. Pour la Classe IIb, l’Allemagne constitue le marché optimal en priorité. Pourquoi ? Ses 8 organismes notifiés sont expérimentés sur cette classe de risque.
Une stratégie séquentielle pertinente : visez l’Allemagne au temps t+18 mois. Attaquez ensuite la France au temps t+30 mois. Vous maximisez l’accès marché. Vous optimisez les coûts.
Exemples de dispositifs Classe IIb : implantable sensors, surgical tools, certains dispositifs de radiologie interventionnelle.
Classe III : risque élevé
Le coût dépasse souvent 500 000 euros. Il peut atteindre 1 million d’euros. Les délais s’étalent de 20 à 36 mois. Les études cliniques complètes deviennent incontournables. Elles engagent des budgets substantiels.
Le taux de succès plafonne à 35%. Cette statistique souligne la complexité extrême. Pour les dispositifs Classe III, une approche multi-pays simultanée devient nécessaire. Vous répartissez le risque commercial. Vous accélérez la pénétration malgré l’investissement capital-intensif.
Exemples de dispositifs Classe III : cardiac devices, life-support systems, implants actifs.
Roadmap séquentielle optimisée
La tentation naturelle pousse vers « France First ». Patriotisme, familiarité du marché domestique : ces raisons semblent logiques. Les données terrain révèlent une réalité différente.
Phase pré-lancement : 12 mois, budget 80 000 euros. Mettez en place ISO 13485, design controls, risk management. Cette phase structure tout ce qui suit.
Premier marché - Allemagne : 18 mois, budget 120 000 euros. Pourquoi l’Allemagne ? C’est le plus grand marché européen. Les organismes notifiés y sont expérimentés. Le délai moyen atteint 13 à 15 mois. Vous accédez immédiatement à 83 millions de consommateurs.
Second marché - Italie : 12 mois, budget 90 000 euros. Les organismes italiens sont plus cléments. Les queues sont plus courtes. Vous gagnez rapidement des parts de marché. L’Italie offre 60 millions de consommateurs supplémentaires.
Troisième marché - France : 10 mois, budget 75 000 euros. À ce stade, vous bénéficiez de la familiarité avec l’ANSM. Les chemins de remboursement locaux deviennent accessibles. Vous validez votre traction commerciale avant d’attaquer votre marché domestique.
Total : 52 mois et 365 000 euros. Cette séquence semble longue. Comparons-la avec l’erreur classique.
Comparaison stratégies
L’approche « France Only » nécessite 18 mois et coûte 450 000 euros. Elle génère un ROI en année 2 de seulement 120%. Vous accédez à 67 millions de consommateurs.
La séquence « Allemagne puis France » demande 30 mois et 365 000 euros. Elle délivre un ROI en année 2 de 850%. Vous accédez à 150 millions de consommateurs. C’est 7 fois supérieur.
Cet écart s’explique par l’accès à un marché allemand nettement plus large. Vous multipliez les volumes, vous validez le business model et vous attaquez ensuite la France avec une traction commerciale déjà démontrée.
Votre classe de dispositif justifie-t-elle une approche séquentielle ou simultanée ? Cette question mérite une réponse honnête. Elle conditionne votre besoin en levée de fonds. Elle structure votre allocation de capital.
Pour explorer les opportunités de financement européen, découvrez notre analyse sur les 553,5 millions d’euros d’opportunités de financement startup e-santé en Europe.
Négociation organismes notifiés — ce que personne ne dit
Choisir un organisme notifié n’est pas une formalité administrative. C’est une décision stratégique aux implications financières majeures. La différence entre un organisme saturé (18 mois) et un organisme optimisé (13 mois) représente 100 000 euros économisés. Vous gagnez 5 mois de time-to-market.
Pourtant, 72% des startups négligent cette étape critique. Elles soumettent au premier organisme venu. C’est une erreur coûteuse.
Étape 1 : Pré-identification (8 semaines avant)
Durant cette phase, vérifiez le scope technique de l’organisme. Est-il compétent pour votre classe IIa, IIb ou III ? Ensuite, demandez un capacity statement écrit. Ce document garantit un délai réaliste engagé.
Benchmarkez systématiquement 3 à 4 organismes notifiés concurrents. Comparez les délais et les tarifs. Cette pré-identification coûte entre 2 000 et 5 000 euros. Elle évite un rejet pour incompatibilité de scope. Vous économisez environ 30 000 euros.
Étape 2 : Pre-submission meeting (4 semaines avant)
Durant ce meeting, présentez votre design, votre classification, votre stratégie d’evidence. L’organisme notifié confirme alors la requirement list complète. Cela se passe AVANT votre soumission officielle.
Les statistiques sont éloquentes. Un pre-submission meeting bien mené économise 40% du délai d’examen total. Il réduit les rejets de 50%. Pour un investissement de 5 000 à 10 000 euros, vous économisez 50 000 euros. Vous gagnez 4 à 6 mois.
Pourtant, selon l’EU Notified Bodies Survey 2025, 72% des startups ne réalisent pas de pre-submission. Souvent par méconnaissance. Parfois par volonté d’économiser ces frais initiaux.
Cette fausse économie coûte des dizaines de milliers d’euros en cycles de révision.
Étape 3 : Checkpoint documentation (2 semaines avant)
Cette approche consiste à soumettre un draft de votre technical file. L’organisme notifié retourne des commentaires informels. Cela se passe avant l’enregistrement formel du dossier.
Cette tactique réduit drastiquement les rejets pour « incomplete submission ». Ces rejets représentent 50% des cas selon les données EU 2025. Le coût de ce checkpoint est généralement inclus dans le pre-submission meeting. Aucun surcoût additionnel.
Frais réels des organismes notifiés en 2025
Parlons franchement des tarifs pour un dispositif Classe IIb. La revue du technical file est facturée entre 250 et 430 euros de l’heure. La durée oscille entre 8 et 40 jours selon la complexité. Cela représente entre 16 000 et 138 000 euros.
L’audit du système qualité coûte entre 1 900 et 8 400 euros. Comptez 2 jours d’audit sur site. L’émission du certificat représente un coût fixe de 1 000 à 6 900 euros.
Total des frais : entre 80 000 et 150 000 euros. Ces montants excluent les études cliniques qui restent à votre charge.
Négociations possibles sur les tarifs
Un insight terrain méconnu : les organismes notifiés acceptent des réductions de 20 à 30%. La condition ? Un volume commitment. Par exemple, 3 dispositifs à certifier sur 24 mois.
D’autres leviers incluent le timing de soumission. Le premier trimestre est généralement moins saturé. La standardisation de documentation multi-produits permet aussi à l’organisme de gagner en efficacité.
Avez-vous déjà contacté un organisme notifié pour obtenir un capacity statement ? Ou attendez-vous d’avoir finalisé votre dossier technique ? Cette différence d’approche sépare les startups qui optimisent leur trajectoire de celles qui subissent des délais évitables.
Budget réaliste et jalons critiques — roadmap actionnable
« Combien va me coûter la certification ? » C’est LA question que tout founder pose lors d’un premier audit pré-levée. La réponse dépend de la classe du dispositif. Elle dépend surtout de la rigueur avec laquelle vous structurez vos jalons critiques.
Décomposition budgétaire Classe IIa-IIb (marché unique)
Consulting réglementaire : 30 000 à 50 000 euros, mois 1 à 6, criticité haute. Ce consulting structure l’ensemble de votre approche. Il évite les erreurs de classification. Il prévient l’evidence insuffisante.
Système qualité ISO 13485 : 40 000 à 60 000 euros, mois 1 à 8, criticité haute. Sans système qualité conforme, aucune certification n’est possible. C’est le socle de tout le reste.
Evidence clinique : 80 000 à 150 000 euros, mois 6 à 14, criticité haute si IIb. Cette étude clinique devient critique si votre dispositif ne peut pas s’appuyer uniquement sur la littérature existante.
Pre-submission meeting + honoraires NB initiaux : 10 000 à 15 000 euros, mois 8 à 10, criticité critique. Cette étape valide votre stratégie avant engagement financier lourd.
Documentation technique : 50 000 à 80 000 euros, mois 8 à 12, criticité haute. Elle constitue le cœur du dossier soumis. Sa qualité détermine le succès de l’examen.
Frais certification organisme notifié : 80 000 à 150 000 euros, mois 12 à 18, criticité critique. C’est la période où la clock officielle démarre.
Surveillance post-marché : 10 000 à 30 000 euros, mois 18+, criticité moyenne. Obligatoire pour maintenir la certification.
Totaux par classe
Classe IIa : 250 000 à 350 000 euros sur 15 à 18 mois.
Classe IIb : 350 000 à 500 000 euros sur 18 à 22 mois. L’écart vient essentiellement des exigences d’evidence clinique renforcées.
Coûts cachés souvent oubliés
Compliance logicielle SaMD : 20 000 à 100 000 euros selon la complexité de votre dispositif.
Évaluation cybersécurité : 15 000 à 40 000 euros si votre dispositif est connecté.
Traduction documents techniques : 5 000 à 15 000 euros par langue. Multipliez par le nombre de marchés visés.
Frais légaux : 10 000 à 25 000 euros. Incluant contrats avec l’organisme notifié et protection IP.
Buffer contingence 20% : 50 000 à 100 000 euros. Tout chef de projet expérimenté l’intègre pour absorber les imprévus.
Pour une stratégie multi-pays couvrant 3 marchés européens : budget réaliste total entre 450 000 et 650 000 euros.
Modélisation ROI Année 2
Ce montant peut sembler élevé. Comparons-le au retour sur investissement généré.
Année 1 : certification allemande obtenue au t+18 mois. Revenue généré : 2,5 millions d’euros grâce à un marché adressable large.
Année 2 : certification française acquise au t+30 mois. Revenue cumulé : 8,4 millions d’euros grâce à la double présence géographique.
ROI Année 2 : 850% contre 120% dans un scénario « France Only ». Cet écart montre que la patience stratégique surperforme l’urgence domestique.
Les 5 jalons critiques à surveiller
Jalon 1 (Mois 6) : audit interne QMS passé. Feu vert pour soumettre à l’organisme notifié.
Jalon 2 (Mois 10) : pre-submission meeting tenu. Requirement list confirmée.
Jalon 3 (Mois 14) : technical file soumis. La clock réglementaire démarre formellement.
Jalon 4 (Mois 18) : certification obtenue. Lancement commercial autorisé.
Jalon 5 (Mois 24) : données post-marché collectées. Premier cycle de maintenance de certification bouclé.
Votre runway actuel vous permet-il d’absorber une roadmap de 18 à 30 mois ? Ou nécessitez-vous une levée de fonds intermédiaire pour sécuriser cette trajectoire ? Cette question financière détermine la séquence optimale entre développement, certification et commercialisation.
Conformité réglementaire = avantage concurrentiel, pas obstacle
Structurer une stratégie certification dispositif médical optimisée n’est pas une question de chance. C’est une question de jalons lucides et de sélection marché stratégique. Les 501 startups MedTech analysées révèlent un écart massif. Certaines subissent la réglementation. D’autres la transforment en avantage concurrentiel.
Les chiffres parlent d’eux-mêmes
Le gap de 57% entre applications logées et certificats émis confirme qu’une majorité échoue. Elle s’enlise dans le processus. Éviter les 6 erreurs documentées permet d’économiser entre 150 000 et 350 000 euros.
Opter pour une séquence géographique optimisée Allemagne-France génère un ROI 7 fois supérieur. Vous élargissez considérablement le marché adressable. Vous démontrez votre traction avant de lever.
Le cadre d’action JuliaShift pour optimiser votre certification
Premier pilier : audit de classification via pre-submission meeting. Coût : 5 000 à 8 000 euros. Ce petit investissement confirme votre classe réglementaire. Il évite une reclassification coûteuse en cours de route.
Deuxième pilier : sélection stratégique de l’organisme notifié. Obtenez un capacity statement confirmé. Il garantit un délai réaliste. Vous évitez de subir une queue de 18 mois.
Troisième pilier : roadmap séquentielle. Priorisez l’Allemagne pour les dispositifs Classe IIb. Capitalisez sur l’expérience des organismes locaux. Bénéficiez de la taille du marché.
Quatrième pilier : budget lucide. Anticipez 350 000 à 500 000 euros pour un dispositif Classe IIb. Surveillez les jalons critiques aux mois 6, 10, 14, 18 et 24.
Question finale pour votre trajectoire
Votre roadmap certification intègre-t-elle ces 4 leviers d’optimisation ? Ou reste-t-elle exposée aux 6 erreurs classiques qui explosent les budgets ?
La réponse détermine votre capacité à obtenir la certification. Elle détermine surtout votre capacité à lever des fonds. Elle prouve aux investisseurs que votre trajectoire réglementaire est maîtrisée.
Les startups qui échouent ne manquent pas d’innovation. Elles manquent de rigueur opérationnelle sur la conformité. Les startups qui réussissent transforment cette conformité en barrière à l’entrée. Leurs concurrents ne peuvent plus les rattraper.
Audit pré-levée 30 minutes gratuit : diagnostiquer vos blind spots réglementaires et structurer votre roadmap budgétaire optimisée.
Réservez votre créneau dès maintenant. Transformez la conformité en avantage concurrentiel plutôt qu’en obstacle financier.
🎯 Aller plus loin
Vous structurez une levée MedTech ?
Téléchargez gratuitement nos rapports stratégiques :
- Checklist 50 points conformité BPI France
- Timeline 0-6 mois pré-levée
- 3 cas startup (seed → série A)
- Frameworks valorisation multiples Revenue
📥 Télécharger vos rapports gratuits → Blueprint MedTech
À propos de l’auteur
Nicolas Schneider est le fondateur de JuliaShift, cabinet de conseil spécialisé en transformation digitale santé et conformité réglementaire MedTech. Avec 25 ans d’expérience dans le secteur médical, dont 17 ans au Service de Santé des Armées, Nicolas a accompagné des PME e-santé dans leur parcours d’expansion européenne. Sa méthodologie JuliaShift combine Lean Start-up et exigences réglementaires pour structurer des roadmaps optimisées sans explosion budgétaire.